倫理指針
「人を対象とする医学系研究に関する倫理指針」
はじめに
2015年4月より「人を対象とする医学系研究に関する倫理指針」(文部科学省、厚生労働省、以下本指針)が施行されたことに対応するために、日本臨床肛門病学会(以下本学会)では、学術集会や学会雑誌などを通じて公表される「人を対象とする医学系研究」は本指針を遵守していることが必須となりました。 つきましては、本学会の学術集会への演題応募や学会雑誌への論文投稿は、症例報告などを除き、倫理審査委員会での審査と、それに基づく施設長の許可を得ていることが必須になります。会員の皆様におかれましては、本指針を遵守いただくとともに、学術集会会長等が示す演題の応募要項や、学会雑誌の論文投稿規定の遵守をお願い致します。
1. 本指針対応の趣旨
本学会は本指針を遵守します。なお学会員は人を対象とする医学系研究を行い、学術集会での発表や論文投稿を行う際には本指針を遵守するとともに、所属施設の倫理指針に従って適切に行動する義務があります。その際には、研究対象者の尊厳と人権を損なうことがないよう留意する必要があります。但し本指針は、学会員の自由な研究活動を制限するためのものではなく、あくまで研究者が研究対象者の福利を最優先に考えて、倫理的に幅広い研究活動を行うための規範にしていただくようお願いいたします。
2. カテゴリー分類と必要な手続き
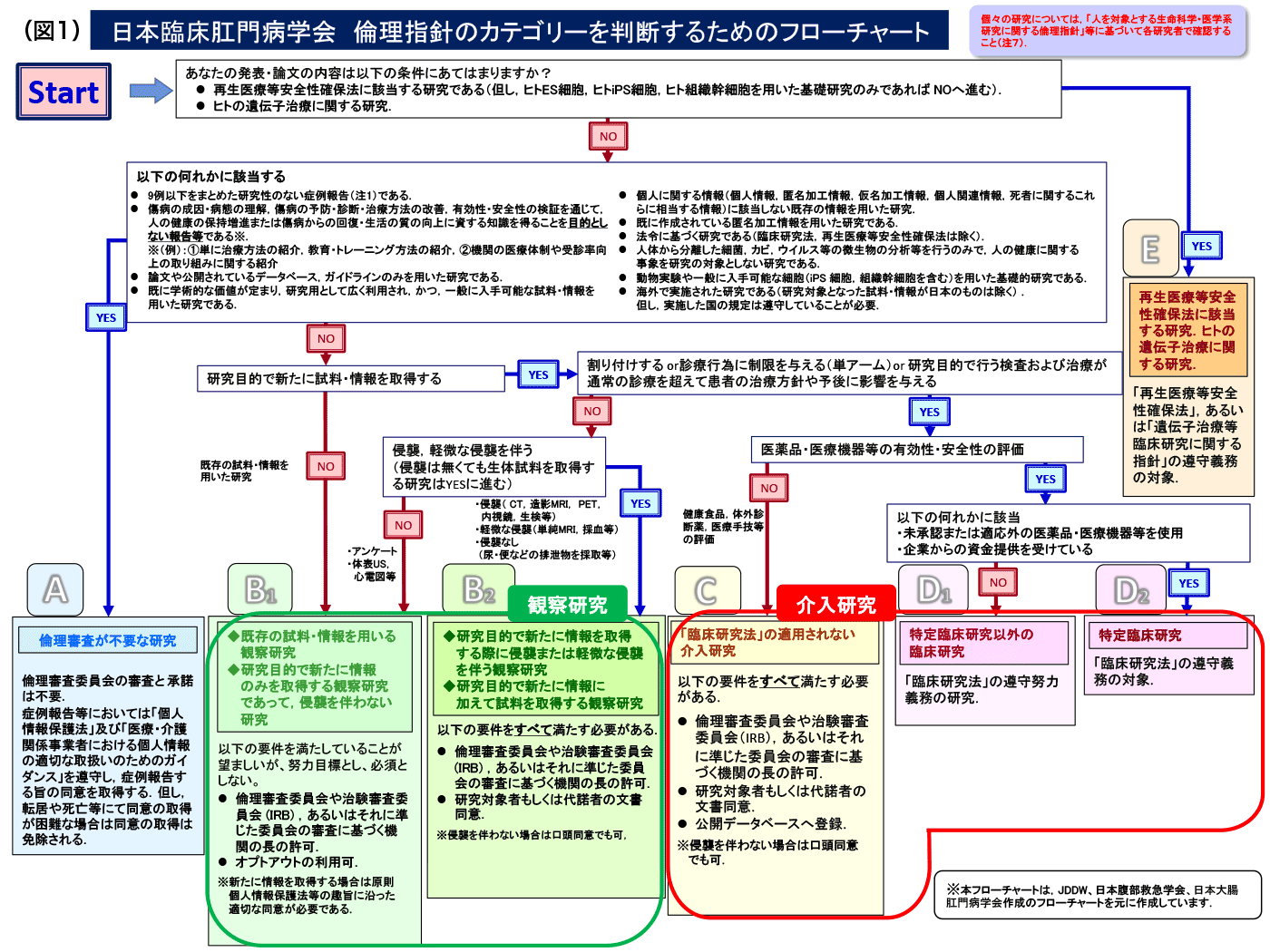
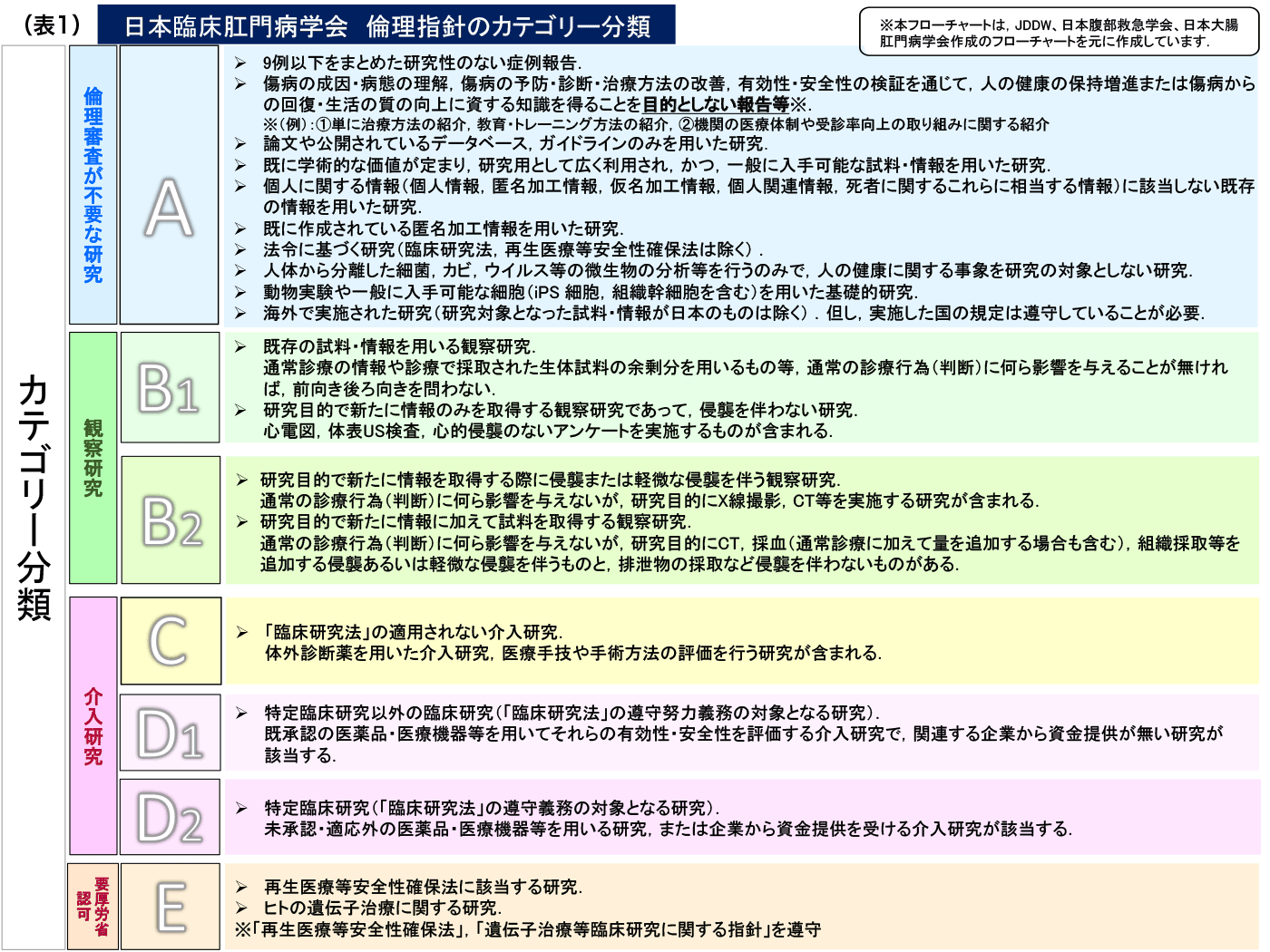
「学会発表・論文投稿における倫理指針のカテゴリー分類(図1.表1)」を以下に付記致します。カテゴリー分類では、臨床研究をその内容からカテゴリーA、B1、B2、C、D1、D2、およびEに分類し、それぞれに該当する臨床研究の内容と、カテゴリーごとに、倫理審査の必要性や同意取得の方法、公開データベースへの登録の必要性を明記しています。学会員の方々は、自身の研究がいずれのカテゴリー分類に該当するのか、確認をお願いいたします。カテゴリーの同定のために、チェックシートを用いることもできます。
日本臨床肛門病学会 演題登録・論文投稿における倫理申請セルフチェックシート
(ここらかダウンロードし、ツールとして利用してください)
フローチャート・カテゴリー分類(PDFファイル)
セルフチェックシートを利用して、カテゴリー分類においてカテゴリー分類がAになった場合は該当する研究は倫理申請不要となります。カテゴリーB1の研究については倫理審査委員会による審査・承認を推奨する努力目標とし、必須条件とはしません。すなわちカテゴリーB1の研究については倫理審査委員会の審査・承認がなくても演題登録・論文投稿は可能とします。
カテゴリー分類のカテゴリーC、D1、D2に含まれる介入研究は、倫理審査および患者もしくは代諾者からの文書同意とともに、研究の実施に先立って公開データベースへの登録が必要になります。公開データベースには、UMIN(大学病院医療情報ネットワーク)、日本医薬情報センター(JAPIC)などがあげられます。特にD1、D2の研究は臨床研究法の対象となります。認定臨床審査委員会での審査と厚生労働大臣への届出が必要です。
同意取得の方法のなかで、オプトアウトという言葉がでてきます。オプトアウトとは、すべての研究対象者からの同意取得が実質的に困難な場合に、当該研究についての情報を、当該施設の掲示板やホームページ上で公開し、研究対象者が研究への参加を拒否する機会を与えることを保障するものです。同時に拒否の意思表示を受け付ける窓口(連絡先)を明示する必要があります。カテゴリー分類のB1に該当する研究ではオプトアウトの利用が可能です。症例報告は、倫理審査や施設長の許可、研究対象者からの同意が不要な研究に該当し、倫理指針では9例以下の成績をまとめた研究が該当します。しかし9例以下の症例報告でも、介入や侵襲を伴う場合や、比較対象症例を加えれば10例を超える場合は、症例報告とはみなされないことに注意する必要があります。また症例報告を行う際には、「症例報告を含む医学論文及び学会研究会発表における患者プライバシー保護に関する指針」を遵守し、研究対象者が特定されないよう注意が必要です。
3. 倫理審査委員会と倫理審査手続き
倫理審査委員会を設置していない施設に属する本学会の会員は、肛門病に関する基礎的又は臨床的な研究について、本学会に設置された倫理審査委員会に審査申請を行うことができます。申請手続等は、以下のとおりです。
- 審査申請手続
下記より各書類を作成し、倫理審査委員会に提出する。
- 様式1〜3 ダウンロード(ワードファイル)
- 様式1〜3 ダウンロード(PDFファイル)
- オプトアウト様式(ツールとして利用してください)
- 審査料
1万円を指定された期日及び方法で支払う。 - 審査結果の通知
本学会から申請者に対し書面をもって通知する。
